Первый раз на Pharmnews.kz?
Войдите, чтобы читать, писать статьи и обсуждать всё, что происходит в мире. А также, чтобы настроить ленту исключительно под себя.
ЗарегистрироватьсяВойдите, чтобы читать, писать статьи и обсуждать всё, что происходит в мире. А также, чтобы настроить ленту исключительно под себя.
Зарегистрироваться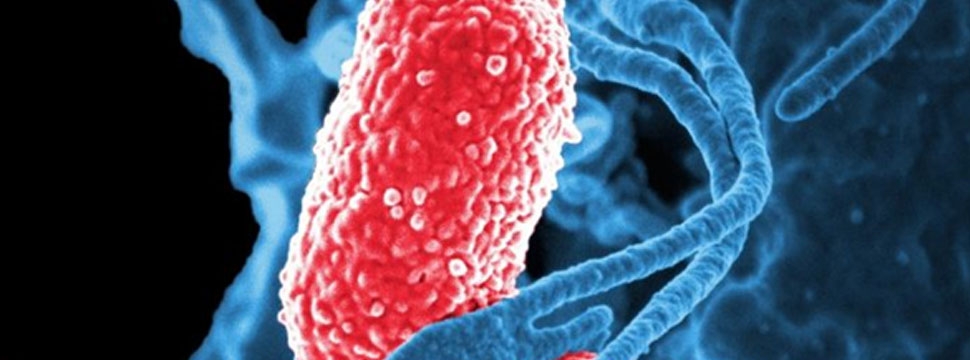
Администрация США по продуктам питания и лекарственным средствам (FDA) одобрила дополнительное применение комбинированного антибактериального препарата RECARBRIO™ (imipenem, cilastatin, relebactam – имипенем, циластатин, релабактам) для лечения пациентов 18 лет и старше с внутрибольничной бактериальной пневмонией и бактериальной пневмонией, связанной с ИВЛ (искусственная вентиляция легких). Ранее препарат компании Merck, известной как MSD за пределами США и Канады, был одобрен для лечения пациентов с осложненными инфекциями мочевыводящих путей и интраабдоминальными инфекциями, у которых нет альтернативных вариантов лечения.
Комбинированный антибиотик активен в отношении следующих грамотрицательных микроорганизмов: Acinetobacter calcoaceticus-baumanniicomplex, Enterobacter cloacae, Escherichia coli, Haemophilus influenzae, Klebsiella aerogenes, Klebsiella oxytoca, Klebsiella pneumoniae, Pseudomonas aeruginosa, Serratia marcescens.
Чтобы уменьшить развитие резистентных к лекарствам бактерий и поддерживать эффективность RECARBRIO™ и других антибактериальных препаратов, данное лекарственное средство следует использовать только для лечения или профилактики инфекций, которые вызваны восприимчивыми бактериями, говорится в сообщении MSD.
Отмечается, что препарат вводится внутривенно и только медицинским работником.
RECARBRIO™ представляет собой комбинацию имипенема (бета-лактамный антибиотик — группа карбапенемов), циластатина (специфический ингибитора почечной дегидропептидазы) и релебактама (новый ингибитор бета-лактамаз).


 загружается...
загружается...


 загружается...
загружается...
Комментарии
(0) Скрыть все комментарии