Первый раз на Pharmnews.kz?
Войдите, чтобы читать, писать статьи и обсуждать всё, что происходит в мире. А также, чтобы настроить ленту исключительно под себя.
ЗарегистрироватьсяВойдите, чтобы читать, писать статьи и обсуждать всё, что происходит в мире. А также, чтобы настроить ленту исключительно под себя.
Зарегистрироваться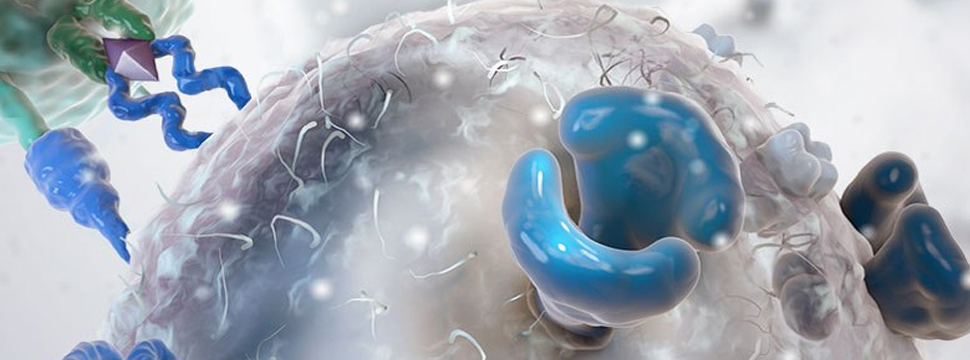
FDA заявило о начале проверки профилей безопасности одобренных CAR-T-клеточных терапий. Причиной стали сообщения о случаях госпитализации и смерти пациентов, принимавших препараты, зарегистрированные американским регулятором.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) проводит проверку безопасности в отношении противоопухолевых препаратов CAR-T-клеточной терапии. Об этом американский регулятор сообщил на своем официальном сайте.
Проверки стали следствием развития Т-клеточных злокачественных новообразований в крови пациентов после прохождения ими CAR-T-клеточной терапии. По данным регулятора, в результате приема препаратов были отмечены случаи госпитализации и смерти. Проблемы с безопасностью приема лекарственных средств были выявлены в процессе изучения данных о побочных эффектах, проявившихся в ходе клинических испытаний и после начала коммерческих продаж.
С 2017 года FDA одобрило шесть методов лечения CAR-T-клетками: Abecma (idecabtagene vicleucel) и Breyanzi (lisocabtagene maraleucel) компании Bristol-Myers Squibb, Carvykti (ciltacabtagene autoleucel) компании Johnson & Johnson, Kymriah (tisagenlecleucel) компании Novartis, Tecartus (brexucabtagene autoleucel) и Yescarta (axicabtagene ciloleucel) компании Gilead Sciences. Все препараты были зарегистрированы для лечения различных видов рака крови.
Лечение CAR-T-клетками представляет собой извлечение из крови пациентов T-лимфоцитов (белых кровяных телец, которые борются с чужеродными веществами, попадающими в организм). Основная проблема заключается в том, что T-клетки в организме не считают раковые клетки опасными и игнорируют их. Поэтому извлеченные T-лимфоциты подвергают генетической модификации и делают из них CAR-T-клетки, после чего возвращают обратно в организм. Такая операция позволяет пациенту начать борьбу с раковой опухолью с помощью собственного иммунитета.
FDA подчеркнуло в своем заявлении, что польза одобренных препаратов по-прежнему перевешивает риски от их приема, что исключает отзыв разрешений на применение этих лекарственных средств. Производители препаратов ответили на запрос портала Fierce Pharma — они уверены в общем профиле безопасности своих продуктов, каждый из которых был протестирован на более чем на нескольких тысячах пациентов.
Комментарии
(0) Скрыть все комментарии