Первый раз на Pharmnews.kz?
Войдите, чтобы читать, писать статьи и обсуждать всё, что происходит в мире. А также, чтобы настроить ленту исключительно под себя.
ЗарегистрироватьсяВойдите, чтобы читать, писать статьи и обсуждать всё, что происходит в мире. А также, чтобы настроить ленту исключительно под себя.
Зарегистрироваться
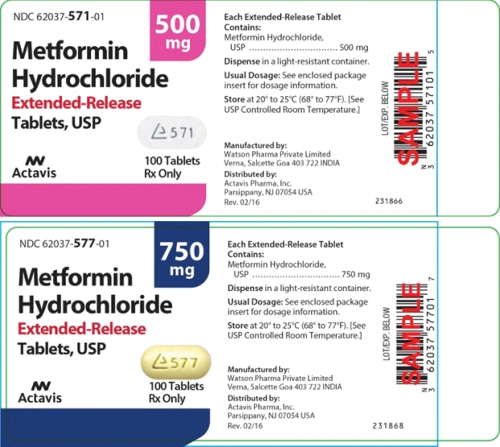
Фармацевтическая компания Teva Pharmaceuticals USA, Inc. объявила о добровольном отзыве с рынка США четырнадцати серий препарата с пролонгированным высвобождением Metformin Hydrochloride 500 мг и 750 мг (метформина гидрохлорид) из-за обнаружения примеси нитрозамина – N-Nitrosodimethylamine (NDMA, N-нитрозодиметиламин), превышающей допустимый предел суточного потребления.
Напомним, что регуляторы классифицируют NDMA, как вероятный канцероген для человека (вещество, которое может вызвать рак). NDMA содержится в питьевой воде и пищевых продуктах, включая мясо, молочные продукты и овощи. Однако, несмотря на то, что нитрозамины могут присутствовать в продуктах питания и воде, наличие их примесей в лекарственных препаратах считается недопустимым.
Препарат метформин применяется при лечении сахарного диабета 2 типа у взрослых (особенно у лиц, страдающих ожирением).
Отзываемые препараты имеют упаковку с обозначением Actavis Pharma, Inc. Они распространялись по всей территории Соединенных Штатов с 8 января 2019 г. по 27 мая 2020 г. (упаковка представляет собой бутылку по 100 и 1000 таблеток):
Таблетки пролонгированного действия метформина гидрохлорид, USP 500 мг, таблетки от белого до не совсем белого цвета, с обозначенным логотипом Andrx и надписью «571» на одной стороне и «500» на противоположной стороне.
Таблетки пролонгированного действия метформина гидрохлорид, USP 750 мг, светло-желтые таблетки, debossed с обозначением логотипа Andrx и надписью «577» на одной стороне и «750» на противоположной стороне.



 загружается...
загружается...
Комментарии
(0) Скрыть все комментарии