Первый раз на Pharmnews.kz?
Войдите, чтобы читать, писать статьи и обсуждать всё, что происходит в мире. А также, чтобы настроить ленту исключительно под себя.
ЗарегистрироватьсяВойдите, чтобы читать, писать статьи и обсуждать всё, что происходит в мире. А также, чтобы настроить ленту исключительно под себя.
Зарегистрироваться
В исследовании NIAGARA III фазы в периоперационном режиме препарат Имфинзи снижал риск развития рецидива на 32% и риск смерти на 25% в сравнении с только неоадъювантной химиотерапией при мышечно-инвазивном раке мочевого пузыря
Первый режим иммунотерапии до операции и после нее продемонстрировал статистически и клинически значимое улучшение общей выживаемости в данных условиях лечения
Позитивные результаты исследования NIAGARA III фазы показали, что по сравнению с неоадъювантной химиотерапией применение препарата компании «АстраЗенека» Имфинзи (дурвалумаб) в комбинации с химиотерапей обеспечило статистически и клинически значимое улучшение в основной конечной точке — бессобытийной выживаемости (БСВ) и ключевой дополнительной конечной точке — общей выживаемости (ОВ) у пациентов с мышечно-инвазивным раком мочевого пузыря (МИРМП). До проведения радикальной цистэктомии (операция по удалению мочевого пузыря) пациентам была проведена терапия препаратом Имфинзи в комбинации с неоадъювантной химиотерапией с последующим назначением препарата Имфинзи в качестве адъювантной монотерапии.
Эти результаты будут представлены на президентском симпозиуме конгресса Европейского общества медицинских онкологов (ESMO) в Барселоне, Испания (тезисы доклада № LBA5) с одновременным опубликованием в журнале The New England Journal of Medicine.
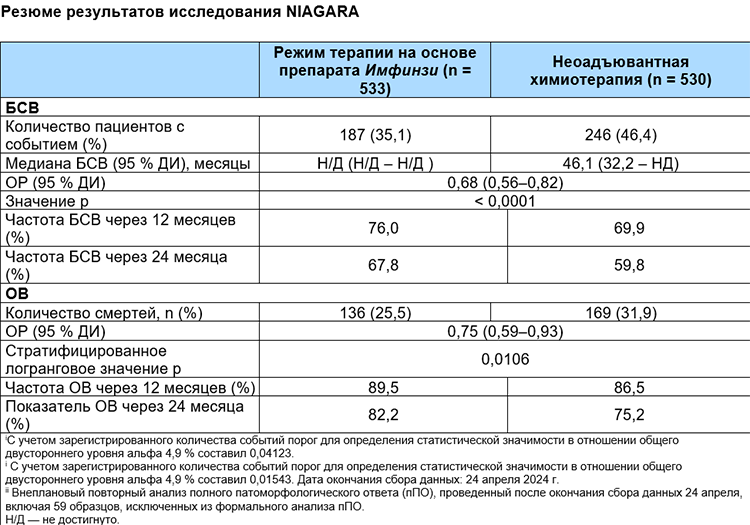
Согласно результатам планового промежуточного анализа у пациентов, получавших лечение препаратом Имфинзи в периоперационный период, наблюдалось снижение риска прогрессирования заболевания, возникновения рецидивов, отказа от хирургического вмешательства или смерти по сравнению с группой сравнения (отношение рисков [ОР] для БСВ) 0,68; 95 % доверительный интервал [ДИ] 0,56–0,82; p < 0,0001). Расчетная медиана БСВ в группе, получавшей препарат Имфинзи , еще не была достигнута по сравнению с 46,1 месяца в группе сравнения. По оценкам, нежелательные явления не были зарегистрированы в течение двух лет у 67,8 % пациентов, получавших препарат Имфинзи, и у 59,8 % пациентов в группе сравнения.
Результаты оценки ключевой дополнительной конечной точки ОВ показали, что терапия препаратом Имфинзи в периоперационном периоде снижает риск смерти на 25 % по сравнению с неоадъювантной химиотерапией с радикальной цистэктомией (ОР для ОВ 0,75; 95 % ДИ 0,59–0,93; p = 0,0106). Ни в одной из групп лечения медиана выживаемости еще не была достигнута. По оценкам, показатели выживаемости через два года составили 82,2 % в группе лечения препаратом Имфинзи, и 75,2 % в группе сравнения.
Профессор Томас Паулс (Thomas Powles), врач, директор онкологического центра при Институте рака Бартса (QMUL), Лондон, Великобритания, и главный исследователь в исследовании NIAGARA, сказал: «Вот уже почти двадцать лет неоадъювантная химиотерапия с удалением мочевого пузыря является основой лечения пациентов с мышечно-инвазивным раком мочевого пузыря; однако у половины пациентов по-прежнему наблюдаются изнуряющие рецидивы. Добавление дурвалумаба до операции и после нее значительно снизило вероятность рецидивов и увеличило выживаемость, что является существенным достижением, предполагающим наличие возможности изменить стандарт лечения для этих пациентов, которые остро нуждаются в более благоприятных исходах».
Исполнительный вице-президент, руководитель подразделения исследований и разработок в области онкологии компании «АстраЗенека» Сьюзан Гэлбрейт (Susan Galbraith) отметила: «Результаты исследования NIAGARA продемонстрировали значительное улучшение как бессобытийной выживаемости, так и общей выживаемости; более того, через два года были живы более 80% пациентов, получавших лечение препаратом Имфинзи в периоперационном периоде. Это первый режим иммунотерапии, значительно увеличивающий общую выживаемость при мышечно-инвазивном раке мочевого пузыря, при этом он дополнительно подтверждает нашу стратегию перехода к лечению рака как можно раньше для обеспечения максимального положительного эффекта для пациентов».
Имфинзи в целом хорошо переносился, и никаких новых сигналов по безопасности при неоадъювантной и адъювантной терапии не наблюдалось. Кроме того, добавление препарата Имфинзи к неоадъювантной химиотерапии соответствовало известному профилю безопасности для этой комбинации и не ставило под угрозу возможность пациентов перенести операцию по сравнению с только неоадъювантной химиотерапией. Нежелательные явления 3–4-й степени тяжести, возникшие по любой причине, были зарегистрированы у 69 % пациентов, получавших препарат Имфинзи, и у 68 % пациентов, получавших неоадъювантную химиотерапию.
Кроме исследования NIAGARA, препарат Имфинзи также включен в различные комбинации лечения в исследованиях у пациентов с раком мочевого пузыря ранней и поздней стадии, в том числе с мышечно-неинвазивным раком мочевого пузыря (POTOMAC), у пациентов с МИРМП, которые не подходят для назначения цисплатина или отказываются от него (VOLGA), и местнораспространенным или метастатическим заболеванием (NILE).



 загружается...
загружается...


 загружается...
загружается...
Комментарии
(0) Скрыть все комментарии